di Marco Bella – Quando è nata l’industria chimica, gli scarti non erano considerati un problema. Poi, succedeva come a Minamata, dove una fabbrica vicino a un villaggio di pescatori in Giappone ha buttato il solfato di mercurio direttamente nel fiume dal 1932 al 1968. Nei sedimenti del fiume c’era una concentrazione di mercurio superiore a quella che si trovava nelle miniere. Il mercurio arrivava al mare e si accumulava nei pesci e molluschi, gli uomini mangiavano i pesci e si avvelenavano con il mercurio. E gli uomini stavano male e morivano e i bambini nascevano malformati.
L’industria chimica si è resa conto che lo scarto non è solo “un problema”, ma è il problema. E che lo scarto che contiene metalli pesanti un problema ancora più grande.
Il 6 ottobre 2021 è stato assegnato il Nobel a List e MacMillan non per cosa hanno prodotto, ma piuttosto per quello che non hanno ottenuto: scarti. Il Premio Nobel all’organocatalisi asimmetrica.
Guardiamo le nostre mani: non sono uguali, ma sono l’una l’immagine speculare l’una dell’altra. Tutti gli oggetti che allo specchio non sono uguali a sé stessi e quindi esistono in coppie (le scarpe, i guanti, ma anche alcune conchiglie e persino le galassie) sono chiamati chirali (dal greco χείρ, “mano”). Si dà il caso che anche le molecole siamo oggetti, e che quindi ciascuna molecola chirale esiste come immagini speculari non sovrapponibili, che da adesso per semplicità chiameremo “mani”.
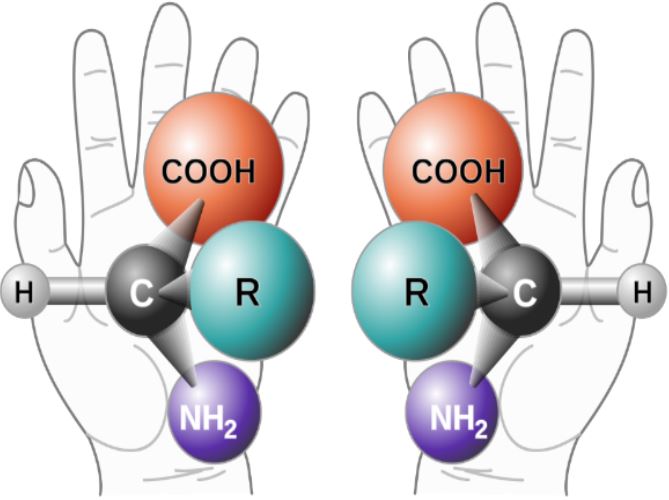
Le molecole chirali esistono in due immagini speculari non sovrapponibili, come la mano destra e sinistra. (immagine da wikipedia)
Preparare una sola “mano”, ma anche separare le “mani”, cioè fare una “sintesi asimmetrica”, è difficilissimo. C’erano dei farmaci di cui si davano entrambe le “mani”, pensando che tanto non cambiasse granché, ma il nostro corpo però le diverse “mani” diverse le riconosce eccome. Il Talidomide era appunto costituito da due “mani”. La mano “destra” era un antiemetico, cioè una sostanza che aiuta a combattere la nausea, e per questo si prescriveva alle donne in gravidanza.
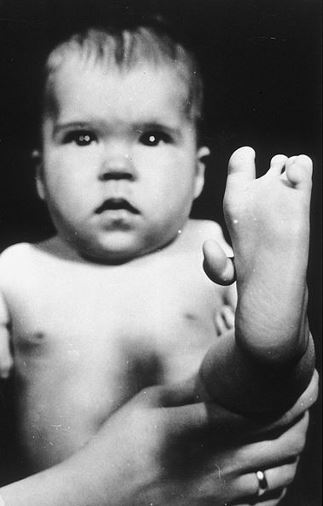
Quella “sinistra” però era un teratogeno, ovvero una sostanza che causava delle gravi malformazioni nei feti come la focomelia, cioè arti ridotti o assenti, come nel bimbo nella foto di seguito che ha solo una gamba e niente braccia.
Quando Talidomide alla fine degli anni ‘50 fu venduto in Europa ci fu un’esplosione di casi di focomelia dovuti alla “mano” sbagliata di questo farmaco. Gli Stati Uniti furono risparmiati perché la farmacologa dell’FDA Frances Kelsey, non a caso una donna, si oppose fermamente ad autorizzare un nuovo farmaco per le donne in gravidanza senza sufficienti studi ed evitò così al suo Paese molte sofferenze.
Il processo per ottenere molecole come una sola “mano” si chiama “catalisi asimmetrica” quando impiega un catalizzatore, cioè una sostanza che accelera la reazione.
Il campo della catalisi asimmetrica ha ricevuto il Nobel nel 2001. I catalizzatori impiegati contenevano dei metalli di transizione (ad esempio il palladio, che costa più dell’oro). Certo: di metalli se ne usavano piccole quantità, ma anche queste piccole quantità erano un problema non da poco. In alcuni processi industriali, i costi legati al catalizzatore metallico arrivano fino al 60% del totale, questo perché i catalizzatori metallici oltre a costare tanto sono difficili da smaltire. Non solo gli scarti di lavorazione, ma persino i reattori possono essere contaminati con i metalli.
Per capire quanto sia rilevante il problema degli scarti nell’industria chimica, consideriamo che per fare un solo chilo di principio attivo di un farmaco con un processo efficiente si usano circa 200 kg di altri composti chimici. Un kg è quello che diventerà la pasticca che usi, 199 kg quello che butti via e per cui devi trovare una soluzione.
Inoltre, per usare alcuni catalizzatori metallici c’è bisogno di un ambiente senza aria e tracce di acqua, che in un laboratorio chimico si può realizzare in modo relativamente facile ma che diventa molto più complesso in un reattore industriale da centinaia di kg.
Qual è stata allora la scoperta dei premi Nobel List e MacMillan? Che queste difficilissime reazioni asimmetriche si potevano realizzare in modo molto più semplice usando come catalizzatori alcune molecole organiche senza impiegare metalli di transizione, e producendo le molecole chirali come singole mani tramite l’organocatalisi asimmetrica. Come catalizzatori non si usavano composti contenenti metalli di transizione, ma sostanze organiche più semplici, come ad esempio la prolina, un amminoacido che si può persino mangiare. Un pochino di acqua poi, faceva andare la reazione persino meglio!
L’organocatalisi asimmetrica è diventata quindi un nuovo approccio per condurre le reazioni chimiche: eliminare i metalli di transizione permette ad esempio di mettere gli scarti in un bioreattore in modo che i batteri degradino tutto.
Tra l’altro, anche dal punto di vista dell’efficienza produrre due “mani” delle molecole, separarle e poi buttarne via una non è una strategia troppo furba. È sicuramente più sensato produrre con l’organocatalisi asimmetrica solo la “mano” che serve, destra o sinistra. Rispettare l’ambiente e soldi significa produrre solo quello che vuoi ottenere, piuttosto che farne il doppio e buttarne via una metà.
Un aspetto interessante è però che l’organocatalisi asimmetrica non è stata affatto scoperta nel 2000, quando sono apparsi i primi articoli di List e MacMillan, ma ci sono studi che risalgono agli anni ’60-70 e addirittura ai primi del ‘900. Se andiamo a ritroso però possiamo dire l’organocatalisi asimmetrica in realtà la ha inventata Dio: infatti gli enzimi sono degli organocatalizzatori efficientissimi che producono solo la “mano” desiderata in modo pressoché perfetto. Va però detto che gli enzimi sono costituiti da centinaia di amminoacidi e per funzionare hanno bisogno di condizioni molto specifiche, ad esempio solo una data temperatura, mentre gli organocatalizzatori invece da un solo amminoacido e possono operano in tantissime condizioni e solventi diversi.
Quindi, l’organocatalisi asimmetrica e le sue potenzialità erano note, eppure inspiegabilmente questa tipo di ricerca è stato trascurato per decenni.
Io ho iniziato a lavorare in questo campo nel 2003 in Danimarca, con il professor Karl Anker Jørgensen, una persona che detta di molti avrebbe meritato anche lui il Nobel. Sono stato uno dei primi a introdurla in Italia nel 2005, tra l’allora scetticismo di molti colleghi. Tra l’altro si può fare con pochissimi soldi, e quando sono tornato a Roma dopo essere stato cinque anni tra USA e Danimarca ho visto che qui di soldi per la ricerca ce ne erano pochissimi. Una reazione organocatalitica asimmetrica sviluppata nel mio laboratorio è divenuta un processo industriale che permette non solo di evitare l’uso di metalli di transizione ma anche di diminuire di un fattore cinquanta il solvente organico impiegato nella sintesi originale. [J. Org. Chem. 2012, 77, 4765]
Qual è stata la spinta decisiva affinché centinaia di ricercatori nel mondo all’improvviso si lanciassero a questo campo? La consapevolezza che è importante non solo cosa e come produci ma anche, se non di più cosa fai degli scarti? O capire finalmente che smaltire i metalli è molto più complesso rispetto ai semplici composti organici? Io voglio credere che sia l’insieme di tante cose, tra cui la presa di coscienza da parte dei chimici (che sono persone intelligenti) dell’importanza della transizione ecologica.
Transizione ecologica non significa tornare al medioevo, ma significa spendere meno. Significa ottenere solo quello che vuoi. Significa limitare il più possibile quello che non vuoi, cioè gli scarti. In una parola sola: transizione ecologica significa efficienza e ricerca da Nobel. Significa muoversi verso un mondo dove lo scarto non è più un problema, perché lo scarto semplicemente non lo produci più o lo riutilizzi.